Болезнь Альцгеймера, также называемая деменцией, при которой память и когнитивные функции постепенно снижаются из-за деформации и гибели нейронов, а болезнь Паркинсона, вызывающая тремор в руках и препятствующем нормальному движению, является основными нейродегенеративными заболеваниями.
Недавно исследовательская группа POSTECH определила структуру агента, который вызывает совместное развитие болезней Альцгеймера и Паркинсона.
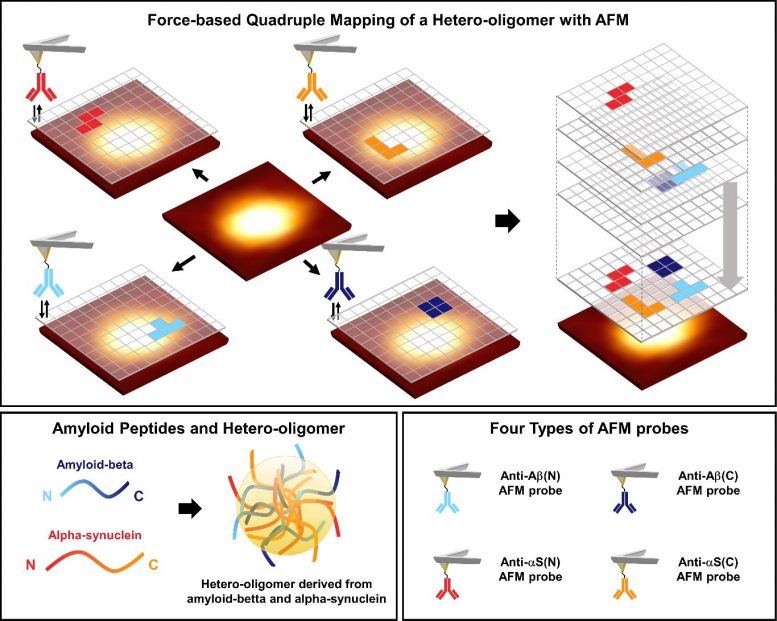
Исследовательская группа под руководством профессора Джун Вон Пак и доктора философии Кандидат Ын Джи Шин из отдела химии POSTECH исследовал структуру поверхности гетероолигомеров, обнаруженных при наложении болезни Альцгеймера и болезни Паркинсона, с помощью атомно-силовой микроскопии (АСМ), чтобы выявить их структурную идентичность. Это исследование было представлено на титульном листе в последнем выпуске Nano Letters.
Известно, что патологическое перекрытие болезни Альцгеймера и болезни Паркинсона связано с образованием гетероолигомеров, полученных из бета-амилоида и альфа-синуклеина. Однако изучение лечения было затруднено из-за технических ограничений в наблюдении за их структурой.
Схематическая диаграмма картирования четырехкратной силы гетеро-олигомеров, полученных из бета-амилоида и альфа-синуклеина. Гетероолигомеры характеризовались четырьмя типами зондов АСМ, связывающих антитело, распознающее каждый конец пептидов.
Для этого исследователи использовали АСМ для наблюдения за характеристиками поверхности гетероолигомерных наноагрегатов, полученных из бета-амилоида, известного как биомаркер болезни Альцгеймера, и альфа-синуклеина, известного как биомаркер болезни Паркинсона, в одномолекулярный уровень.
Этот результат указывает на то, что конец каждого пептида имеет большую тенденцию располагаться на поверхности гетероолигомеров, чем гомоолигомеры, или что концы пептидов, расположенные на поверхности, имеют больше степеней свободы. Таким образом, можно подтвердить, что агрегация между пептидами в гетероолигомере более рыхлая, чем в гомоолигомере.
Это первое исследование, в котором наблюдалась структура неупорядоченных наноагрегатов белков, которая никогда не была идентифицирована ранее, с использованием четырехкратного картирования с четырьмя наконечниками АСМ. Это служит экспериментальным основанием для проверки гипотезы об агрегации гетероолигомеров. Его также можно использовать в исследованиях, связанных с перекрывающимися явлениями различных нейродегенеративных заболеваний, отличных от болезней Альцгеймера и Паркинсона.